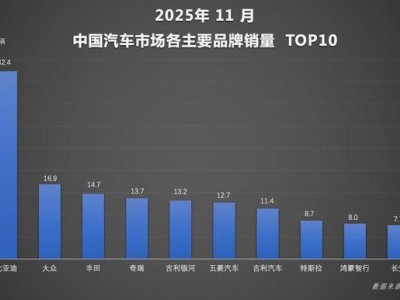
君實(shí)生物近日宣布,其自主研發(fā)的EGFR/HER3雙特異性抗體偶聯(lián)藥物JS212,已正式獲得美國(guó)食品藥品監(jiān)督管理局(FDA)批準(zhǔn)開展臨床試驗(yàn)。該藥物旨在為晚期實(shí)體瘤患者提供新的治療選擇,標(biāo)志著公司在腫瘤創(chuàng)新藥研發(fā)領(lǐng)域取得重要進(jìn)展。
根據(jù)公開資料顯示,JS212是一種重組人源化雙特異性抗體偶聯(lián)藥物,通過(guò)同時(shí)靶向表皮生長(zhǎng)因子受體(EGFR)和人表皮生長(zhǎng)因子受體3(HER3),實(shí)現(xiàn)精準(zhǔn)腫瘤殺傷。該藥物采用新型連接子技術(shù),可有效降低傳統(tǒng)化療藥物的毒副作用,同時(shí)增強(qiáng)對(duì)腫瘤細(xì)胞的特異性識(shí)別能力。
此次獲批的臨床試驗(yàn)將針對(duì)多種晚期惡性實(shí)體瘤展開,包括但不限于非小細(xì)胞肺癌、結(jié)直腸癌等高發(fā)癌種。公司研發(fā)團(tuán)隊(duì)表示,JS212在臨床前研究中展現(xiàn)出良好的安全性和抗腫瘤活性,其獨(dú)特的作用機(jī)制有望突破現(xiàn)有治療方案的局限性。
業(yè)內(nèi)專家指出,雙特異性抗體偶聯(lián)藥物是當(dāng)前腫瘤治療領(lǐng)域的前沿方向,JS22的獲批標(biāo)志著中國(guó)藥企在該賽道實(shí)現(xiàn)技術(shù)突破。隨著全球腫瘤發(fā)病率持續(xù)上升,創(chuàng)新療法的研發(fā)對(duì)于改善患者生存質(zhì)量具有重要意義。君實(shí)生物將持續(xù)推進(jìn)該藥物的國(guó)際多中心臨床試驗(yàn),為產(chǎn)品最終上市奠定基礎(chǔ)。